. Wstęp
Toksyczne zakwity sinic (ang. cyanobacterial harmful algal blooms, CyanoHabs) to zjawiska, które w ostatnich dziesięcioleciach stanowią obiekt zainteresowań wielu grup badawczych na całym świecie. Badania koncentrują się głównie na negatywnym wpływie zakwitów sinicowych w ekosystemach wodnych oraz na szeroko pojętych właściwościach toksycznych metabolitów wtórnych produkowanych przez te mikroorganizmy – tzw. toksynach sinicowych. W dobie zmian klimatycznych, a także coraz dalej posuniętych modyfikacji środowiska naturalnego spowodowanych działalnością człowieka, zakwity sinicowe pojawiają się coraz częściej. W konsekwencji zmiany warunków abiotycznych i biotycznych generowanych np. odprowadzaniem zanieczyszczeń komunalnych oraz przemysłowych do cieków i zbiorników wodnych czy nadmiernym wykorzystaniem nawozów sztucznych na polach uprawnych zakwity notowane są w miejscach, w których wcześniej nie występowały. Stanowi to poważny problem, ponieważ nadmierna ilość sinic silnie zaburza relacje ekologiczne bezpośrednio w danym zbiorniku wodnym, a także interferuje na ekosystemy z nim powiązane (Huisman et al., 2018; Nowicka-Krawczyk et al., 2022; Svirčev et al., 2019).
Zbyt duża ilość sinic zwiększa mętność wody, uniemożliwiając transfer promieni świetlnych do głębszych warstw zbiornika, co z kolei skutecznie zaburza procesy fotosyntetyczne innych fotoautotrofów. W połączeniu z intensywnym i szybkim metabolizmem sinic oraz relatywnie krótkim cyklem życiowym (najczęściej nieprzekraczającym dwóch miesięcy), który kończy się lizą komórek, w zbiorniku szybko dochodzi do zmniejszenia stężenia tlenu (anoksji). Niewystarczająca ilość tlenu prowadzi do śmierci zwierząt wodnych takich jak ryby, mięczaki czy skorupiaki. Silny nieprzyjemny zapach, który powodowany jest przez inicjację procesów gnilnych oraz zielono-sina woda często pokryta pianą sprawiają, że walory estetyczne zbiornika wodnego, w którym wystąpił zakwit sinic, bywają trwale obniżone (Funkey et al., 2014; Molot et al., 2014; Sukenik et al., 2012; Yan et al., 2017).
Wciąż słabo nagłośnioną w przestrzeni publicznej, a negatywną konsekwencją zakwitów sinic, jest uwalnianie przez nie do wody związków, które należą do jednej z najniebezpieczniejszych grup toksyn syntetyzowanych przez żywe organizmy. W świetle corocznych alertów sinicowych ogłaszanych w krajowych kąpieliskach, w tym często na wybrzeżu Morza Bałtyckiego, wydaje się, że wiedza na temat szkodliwego oddziaływania toksyn syntetyzowanych przez sinice powinna być szerzej rozpowszechniona (Al-Ghelani et al., 2005; De Figueiredo et al., 2004; Massey et al., 2022; Máthé et al., 2013).
. Cylindrospermopsyna – cytotoksyczny związek syntetyzowany przez sinice
Jednym z najsilniej działających związków pochodzenia sinicowego jest cylindrospermopsyna (CYN), która jest cyklicznym alkaloidem o właściwościach cytotoksycznych (Rycina 1). Udowodniono, że zaburza ona szereg procesów metabolicznych w komórkach zarówno roślinnych, jak i zwierzęcych, w tym również człowieka. Szkodliwe działanie CYN u zwierząt kręgowych objawia się głównie w komórkach wątroby, przez co początkowo związek ten został sklasyfikowany jako hepatotoksyna. Późniejsze badania dowiodły jednakże, że CYN posiada także działanie dermatotoksyczne, genotoksyczne i najprawdopodobniej kancerogenne (Adamski et al., 2020b; De La Cruz et al., 2013; Moreira et al., 2013).
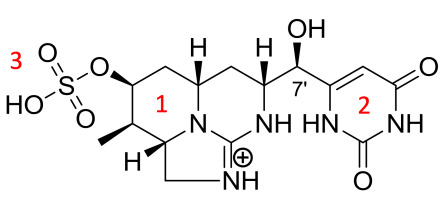
Rycina 1
Struktura chemiczna CYN: 1 – tricykliczne ugrupowanie guanidynowe, 2 – pierścień uracylowy, 3 – grupa sulfonowa (oprac. M. Adamski, J. Piątek, M. Solarska).
Najbardziej znanym przypadkiem zatrucia CYN przez ludzi jest incydent zwany z ang. Palm Island mystery disease, który miał miejsce pod koniec lat 70. w Queensland, w Australii. Wówczas to 139 osób, głównie dzieci, wykazywało objawy silnego zatrucia pokarmowego i wymagało hospitalizacji. Jak dowiedziono, powodem wystąpienia choroby było spożycie wody z rezerwuaru, w którym pojawił się zakwit posiadającej zdolność syntezy CYN sinicy – Raphidiopsis raciborskii (dawniej Cylindrospermopsis raciborskii) (Bourke et al., 1983; Hawkins et al., 1985).
Od momentu ustalenia przyczyn incydentu z Queensland, badania poświęcone CYN stanowią ważny aspekt studiów dotyczących bioaktywnych związków syntetyzowanych przez sinice. Udowodniono, że zdolność produkcji CYN posiada szereg słodkowodnych gatunków sinic, należących do różnych rodzajów np. Anabaena, Raphidiopsis, Umezakia. Pojawianie się tej toksyny potwierdzano na wszystkich kontynentach (Adamski et al., 2020a; Svirčev et al., 2019). W Polsce po raz pierwszy odnotowano jej występowanie w wielkopolskich jeziorach – Bytyńskim i Bnińskim (Mankiewicz-Boczek et al., 2012). Wiedza na temat właściwości fizykochemicznych CYN oraz sposobu jej oddziaływania na żywe komórki organizmów jest relatywnie szeroka. Niestety, niewiele wiadomo na temat faktycznego wpływu tego związku w środowisku naturalnym. Niewiele wiadomo również o środowiskowych ścieżkach jego dekompozycji.
. Fitoremediacja CYN
W ostatnich latach często poruszanym zagadnieniem jest konieczność wypracowania skutecznego systemu pozwalającego przewidywać pojawianie się zakwitów sinicowych oraz efektywnie przeciwdziałać ich rozwojowi. Obiecujące efekty uzyskano wykorzystując jako fitoremediatory rośliny naczyniowe (np. Lemna trisulca), które zmniejszają intensywność podziałów komórek sinic i/lub usuwają uwalniane przez nie toksyny (Kaminski et al., 2014). Innym, ważnym aspektem tych badań, jest potencjalne wykorzystanie katalizatorów zdolnych do dekompozycji cząsteczek toksyn. W niniejszej pracy zebrano informacje dotyczące katalitycznego rozkładu CYN.
. Czynniki powodujące rozkład CYN
CYN jest związkiem charakteryzującym się bardzo wysoką stabilnością chemiczną (Adamski et al., 2016a, 2016b; Chiswell et al., 1999). Abiotyczne czynniki takie jak pH, promieniowanie UV, czy temperatura powodują jej dekompozycję dopiero w skrajnych, testowanych zakresach wartości (np. w roztworach silnie zasadowych pod wpływem temperatury wrzenia). Cząsteczka CYN jest stabilna w kwasowym pH, nawet w temperaturze wrzenia lub w trakcie oddziaływania promieniowania UV o natężeniu przewyższającym środowiskowe wartości. Do rozkładu CYN dochodzi dopiero w momencie alkalizacji środowiska reakcji (pH około 10), przy czym samo pH tylko w ograniczonym stopniu powoduje dekompozycję toksyny. Dopiero wysoka wartość pH w połączeniu z innymi czynnikami (np. promieniowaniem UV lub wysoką temperaturą) umożliwiają osiągnięcie całkowitego rozkładu CYN. Potrzeba na to jednakże od kilkunastu do kilkudziesięciu godzin, w zależności od zastosowanych warunków. Wykazano także, że napromieniowanie CYN światłem PAR (ang. photosyntetic active radiation – promieniowanie fotosyntetycznie aktywne) nie wpływa na stabilność jej cząsteczki (Adamski et al., 2016a, 2016b; Chiswell et al., 1999; Wormer et al., 2008; Wörmer et al., 2010).
Można przypuszczać, że w środowisku naturalnym natężenia czynników abiotycznych, najprawdopodobniej niestety nie inicjują dekompozycji CYN. Z oczywistych powodów, ingerencja w naturalne środowisko zbiornika wodnego, która prowadziłaby do wytworzenia korzystnych dla rozpadu CYN warunków, jest niemożliwa. Podjęto zatem próby wykorzystania czynników abiotycznych w zakresach występujących w naturze, w celu aktywacji katalizatorów rozkładających tę toksynę. Katalizatory te obejmują głównie związki, których oddziaływanie prowadzi do wystąpienia wysokiego stężenia wolnych rodników, zdolnych do modyfikacji strukturalnych cząsteczki CYN. Powstawanie wolnych rodników najczęściej ma miejsce w trakcie traktowania katalizatora promieniowaniem UV lub zakresem światła widzialnego. Istnieją także katalizatory, których aktywacja odbywa się poprzez napromieniowanie szerszym zakresem np. łącznie UV z widzialnym. Dla osiągnięcia pożądanych efektów katalitycznych w dekompozycji CYN, niektóre związki muszą być jednakże poddawane działaniu pełnego zakresu światła słonecznego. W ostatnich latach pojawiły się doniesienia o katalizatorach, które nie wymagają aktywacji promieniowaniem lub działających w połączeniu z innymi procesami (np. ozonowaniem; Adamski et al., 2020a; De La Cruz et al., 2013).
. Katalityczny rozkład CYN – wykorzystanie tlenku tytanu
Pierwsze informacje dotyczące katalitycznego rozkładu CYN obejmują wykorzystanie komercyjnych źródeł tlenku tytanu(IV) (TiO2) – Degussa P-25 oraz Hombikat UV-100, których aktywację przeprowadzano z wykorzystaniem promieniowania UV (Senogles et al., 2001). Mieszaninę reakcyjną o relatywnie prostym składzie, obejmującym oprócz TiO2 i CYN (100 µg/ml) także cząsteczki węgla organicznego oraz wodę pochodzącą z naturalnego źródła, poddawano oddziaływaniu promieniowania. Uzyskane wyniki zaświadczyły o wysokiej wydajności TiO2 w usuwaniu CYN, a jej kompletny rozkład, przy zastosowaniu Degussa P-25, miał miejsce w ciągu 5 min. Hombikat UV-100 wykazywał mniejszą wydajność dekompozycji toksyny – rozkład ok. 50% wyjściowego stężenia w czasie 5 min. Wykazano również, że rozpadowi CYN zachodzącemu pod wpływem TiO2, sprzyja głównie zasadowe środowisko, natomiast temperatura i stężenie węgla organicznego mają mniejszy wpływ na kinetykę tej reakcji. Stwierdzono także, że CYN w odróżnieniu od innych testowanych toksyn sinicowych (np. mikrocystyn) nie adsorbuje się do TiO2, co w tym przypadku znacząco ułatwia przeprowadzenie jej rozkładu (Senogles et al., 2001).
Uzupełniające informacje dotyczące interakcji TiO2-CYN w warunkach oddziaływania UV przedstawili Chen et al. (2015), wiążąc intensywną dekompozycję toksyny w warunkach zasadowych z wzajemnym przyciąganiem dodatnio naładowanej cząsteczki TiO2 i obdarzonej ujemnym ładunkiem grupy sulfonowej CYN. Ponadto udowodniono, że wśród testowanych, powstających w trakcie fotokatalitycznej dekompozycji CYN rodników tlenowych, rodnik hydroksylowy (OH) cechuje się największą aktywnością względem toksyny. Z wykorzystaniem wysokosprawnej chromatografii cieczowej połączonej ze spektrometrią masową (ang. high performance liquid chromatography-mass spectrometry, HPLC-MS) oznaczono produkty dekompozycji CYN i na tej podstawie zaproponowano mechanizm rozkładu jej cząsteczki. Obejmuje on w pierwszej kolejności utlenianie, a następnie hydroksylację pierścienia uracylowego. Wykazano, że przy konieczności wytworzenia zasadowego środowiska reakcji, warunkiem niezbędnym do efektywnego procesu dekompozycji jest obecność tlenu (Chen et al., 2015).
Studia nad wykorzystaniem aktywowanych różnymi zakresami promieniowania (UV-A, zakres widzialny oraz światło słoneczne) komercyjnych katalizatorów stanowiących źródło TiO2 (Degussa P-25 i Kronos vlp-7000), ze szczególnym uwzględnieniem tworzących się produktów rozkładu CYN, zostały podjęte przez Fotiou et al. (2015). W przeprowadzonych testach Degussa P-25 w porównaniu z Kronos vlp-7000 wykazywał większą efektywność dekompozycji CYN w warunkach oddziaływania UV-A oraz światła słonecznego, a całkowity rozpad toksyny następował po odpowiednio 15 i 40 min. Należy podkreślić wysoką efektywność reakcji z Degussa P-25, która kończyła się pełną mineralizacją wyjściowej formy toksyny. Oznaczone w tych warunkach produkty jej rozpadu to związki tworzące się wskutek izomeryzacji, oderwania grupy sulfonowej, zniszczenia pierścienia uracylowego oraz rozszczepienia ugrupowania guanidynowego. Stosunek masy do ładunku (m/z) powstałych pochodnych mieścił się w przedziale 449,12 – 194,13. Autorzy wskazali na oddziaływanie wolnych rodników w wielu miejscach struktury CYN jako główną przyczynę jej rozpadu. W świetle widzialnym przy udziale Degussa P-25 reakcja dekompozycji nie zachodziła, a Kronos vlp-7000 indukował ją tylko w niewielkim stopniu (15% po 10 h) (Fotiou et al., 2015).
Badania z wykorzystaniem Degussa P-25 jako czynnika rozkładającego CYN przeprowadzili także Zhang et al. (2015), którzy do jego aktywacji w środowisku o obojętnym odczynie wykorzystali promieniowanie UV (2,3 mW/cm2). Eksperymenty zostały rozszerzone o inny katalizator – polimorficzny TiO2 (PM-TiO2) zawierający fazę anatazową (66%), brookitową (22%) oraz rutylową (12%). Degussa P-25 w porównaniu do PM-TiO2 z większą efektywnością inicjował dekompozycję toksyny. Opisane w tych warunkach produkty dekompozycji (m/z 290,08 – 466,12) to związki, które powstały głównie w wyniku działania OH. Rodnik ten najprawdopodobniej reagował z obecnymi w cząsteczce CYN wiązaniami C=C, prowadząc do jej hydroksylacji, a następnie dalszych przekształceń strukturalnych: eliminacji grupy sulfonowej, modyfikacji pierścienia uracylowego oraz zmianach w ugrupowaniu guanidynowym. Oprócz charakterystyki fizykochemicznej powstałych pochodnych przeprowadzono także dedykowane im testy toksyczności. Wykorzystano cechujące się wysoką wrażliwością względem CYN komórki raka wątroby (linii C3A) i stwierdzono, że w zastosowanych warunkach produkty fotokatalitycznego rozkładu CYN wykazują znacząco mniejszy stopień toksyczności w porównaniu do wyjściowej formy toksyny (Zhang et al., 2015).
. Czy można zwiększyć efektywność odziaływania fotokatalizatorów TiO2?
Możliwości katalitycznego rozkładu CYN z wykorzystaniem TiO2 weryfikowano także stosując inne środowiska reakcji, bądź modyfikując formę katalizatora. Pelaez et al. (2012) wykorzystali katalizator P-25, który został włączony w skład zawierającego także azot i fluor większego kompozytu. Synteza złożonego kompozytu umożliwiła powstanie dużej powierzchni czynnej katalizatora oraz zwiększenie jego aktywności w trakcie działania promieniowania. Dekompozycję CYN przeprowadzano w kwasowym środowisku reakcji (pH 3) pod wpływem światła widzialnego lub UV–VIS. Wykazana adsorpcja CYN do powstałego kompozytu była jednak w porównaniu do innych toksyn sinicowych niewielka, a jej rozkład pod wpływem światła widzialnego zachodził z niesatysfakcjonującą wydajnością. Lepsze efekty osiągnięto, stosując promieniowanie UV – całkowity zanik wyjściowej formy toksyny następował po 4 h (Pelaez et al., 2012).
Trudności w usuwaniu CYN za pomocą TiO2 w warunkach odczynu lekko zasadowego (wartość pH około 8) i przy udziale światła UV stwierdzili natomiast Pinho et al. (2015). Oszacowana przez nich energia promieniowania potrzebna do rozłożenia 50% wyjściowego stężenia toksyny (70 µg/L) przy udziale TiO2 (200 mg/L) wyniosła 8,7 kJ/L.
Zwiększenia efektywności odziaływania TiO2 w kierunku usuwania CYN próbowano dokonać także poprzez równoczesne wykorzystywanie ozonowania. Wu et al. (2015) testowali mieszaniny reakcyjne obejmujące roztwory syntetyczne oraz zawierające naturalne matryce pochodzenia rzecznego. Uzyskane wyniki wykazały, że początkowa ilość CYN (2,5 mg/L) w warunkach odczynu obojętnego przy zastosowaniu 500 mg/L TiO2 oraz ozonu w stężeniu > 0,5 mg/L ulegała dekompozycji w czasie 30 min. Analizując wyniki testu toksyczności opierającego się na pomiarze luminescencji bakterii Vibrio fischerii dowiedziono zmniejszenia stopnia bioaktywności CYN poddawanej zastosowanym reakcjom (Wu et al., 2015).
Do usuwania CYN wykorzystywano także w pełni syntetyzowane w warunkach laboratoryjnych katalizatory, składające się z połączonych faz anatazowych oraz brukitowych (El-Sheikh et al., 2017). Łączenie ze sobą tych dwóch źródeł TiO2, umożliwiło powstanie katalizatora, którego powierzchnia czynna wielokrotnie przewyższała powierzchnie czynne obu składników rozpatrywanych osobno. Pełna dekompozycja CYN przy udziale tak skonstruowanego kompozytu trwała 15 min i wymagała oddziaływania promieniowania UV–VIS (175 × 10−3 µM/min). Autorzy szczegółowo opisali możliwości syntezy katalizatorów opartych na fazach anatazowo-brukitowych oraz modyfikacje dotyczące ilościowego udziału poszczególnych faz w finalnym kompozycie (El-Sheikh et al., 2017).
Przykładem zaawansowanych modyfikacji fotokatalizatorów TiO2 są także specjalistyczne nośniki fazy katalitycznej, określane jako hybrydowe fotokatalityczne kompozyty (ang. hybrid photocatalytic composites, HPCs). Chae et al. (2019) skonstruowali nanorurki TiO2, na które zostały nałożone pokrycia węglowe. Wysoki stopień porowatości takiego układu (47%), umożliwił wytworzenie efektywnego systemu filtracyjnego do oczyszczania wody zawierającej CYN. Badane HPCs w warunkach oddziaływania promieniowania UV (1.6 mW/cm2) w porównaniu do innych opisywanych wcześniej systemów katalitycznych, charakteryzowały się mniejszą efektywnością usuwania CYN – w ciągu 2 h wyjściowe stężenie toksyny (100 µg/L) zmniejszyło się o około 40% (Chae et al., 2019).
Fotokatalityczne właściwości TiO2 w inicjowaniu dekompozycji CYN zostały także opisane na podstawie modelu jej pierścienia uracylowego – 6-hydroksymetylouracylu (Zhao et al., 2014). Związek ten ulegał relatywnie szybkiej dekompozycji w warunkach oddziaływania fotokatalizatorów TiO2 wzbogaconych o azot, fosfor bądź siarkę. Pod wpływem promieniowania UV rozpad modelu toksyny następował w każdych testowanych warunkach reakcji, przy czym najbardziej efektywnym spośród badanych katalizatorów okazał się ten zawierający azot. Podczas jego oddziaływania całkowita dekompozycja została osiągnięta w ciągu 2 h. Przeprowadzono również analogiczne testy, wykorzystując promieniowanie widzialne, jednakże, w tych warunkach, żaden z użytych katalizatorów nie przyczynił się do pełnego rozkładu 6-hydroksymetylouracylu (Zhao et al., 2014). Schemat potencjalnego katalitycznego rozkładu CYN z uwzględnieniem najczęstszych typów produktów jej dekompozycji, na przykładzie katalizatora TiO2, przedstawiono na Rycina 2.
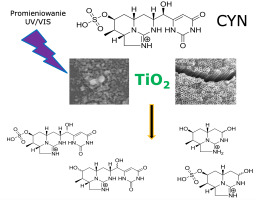
Rycina 2
Schemat katalitycznego rozkładu cylindrospermopsyny (CYN) na przykładzie katalizatorów zawierających TiO2 aktywowanych promieniowaniem UV/VIS (oprac. M. Adamski, J. Piątek, M. Solarska). Obrazy mikroskopowe katalizatorów: Pelaez et al., (2012), Chae et al., (2019).
Oprócz wyżej opisanych badań dotyczących bezpośredniego usuwania CYN z wody za pomocą katalizatorów TiO2 podjęto także próby wykorzystywania takich układów do niszczenia całych komórek sinic. Jin et al. (2019) do degradacji nici R. raciborskii wykorzystali aktywowany światłem widzialnym TiO2 z azotem (N-TiO2). Wykazali, że działanie katalizatora niszczy błony komórkowe i uwalnia zawartość protoplastu. Następnie, tworzące się wolne rodniki reagują z substancjami komórkowymi, prowadząc do ich dekompozycji. Zastosowany układ katalityczny (200 mg/L) w czasie 20 h umożliwił całkowitą destrukcję komórek R. raciborskii(5 × 106/ml) oraz rozkład prawie 90% uwolnionych z nich substancji (Jin et al., 2019).
. Inne układy katalityczne stosowane w usuwaniu CYN
Równolegle do najczęściej wykorzystywanych katalizatorów zawierających TiO2 projektowano doświadczenia, w których stosowano inne układy katalityczne. Dowiedziono, że wolne rodniki pochodzące od S2O82−, HSO5− i H2O2 (głównie hydroksylowy i siarczanowy), pod wpływem promieniowania UV równie skutecznie inicjują dekompozycję CYN (He et al., 2013, 2014). Spośród wyżej wymienionych w najniższym testowanym natężeniu promieniowania (20 mJ/cm2) S2O82− (1 mM) okazał się najbardziej efektywny w usuwaniu toksyny (1 µM). Działanie tworzących się wolnych rodników i reakcja dekompozycji CYN przebiegały podobnie jak miało to miejsce w przypadku układów katalitycznych z TiO2 (He et al., 2013, 2014). Wang et al. (2014) do rozkładu CYN zastosowali bromotlenek bizmutu (BiOBr), który aktywowany był promieniowaniem UV lub światłem widzialnym. Uzyskane wyniki wykazały większą efektywność tego układu katalitycznego (0,2 g/L) w trakcie oddziaływania promieniowaniem VIS – całkowity rozkład CYN nastąpił w ciągu 3,5 h. Pełna dekompozycja CYN w analogicznych warunkach, lecz przy udziale promieniowania UV wymagała więcej niż 14 h. Mechanizm rozpadu toksyny w tym przypadku nie różnił się znacząco od reakcji opisanych wyżej dla innych układów katalitycznych i obejmował oddziaływanie rodnika hydroksylowego, a następnie sukcesywny rozpad cząsteczki CYN. Tworzące się w testowanych warunkach produkty posiadały wartości m/z mieszczące się w przedziale 449 – 319,4 (Wang et al., 2014).
Munoz et al. (2019) do rozkładu CYN wykorzystali odmienny układ katalityczny – bez aktywacji promieniowaniem, a indukowanie reakcji przeprowadzano za pomocą zmodyfikowanego naturalnego magnetytu, dodawanego do środowiska reakcji wraz z nadtlenkiem wodoru (Fe3O4-R400/H2O2). Dekompozycja toksyny zachodziła w kwasowym środowisku reakcji (pH 5) i temperaturze 25 °C. Wyjściowe stężenie CYN (500 µg/L) uległo rozkładowi w czasie 120 min. Stężenie magnetytu i H2O2 wynosiło odpowiednio 0,2 g/L i 3 mg/L. Dodatkowo dobra wydajność takiego układu katalitycznego została potwierdzona w zawierającej CYN próbce wody środowiskowej, w której w tożsamych warunkach fizykochemicznych pełny rozpad toksyny następował w ciągu 240 min. Zwiększenie stężenia magnetytu do 1 g/L skutkowało jednakże całkowitą dekompozycją CYN już w czasie 60 min. Niestety, oparte na skorupiakach Artemia salina testy toksyczności, wykazały utrzymującą się bioaktywność powstałych pochodnych – stężenie powodujące śmierć 50% zwierząt (ang. lethal concentration, LC50) wynosiło po 72-godzinnej ekspozycji 0,3 mg/L (Munoz et al., 2019).
. Podsumowanie
Problemy związane z zakwitami sinicowymi, a tym samym także z toksynami pochodzenia sinicowego najprawdopodobniej już w najbliższej przyszłości będą się nasilać. Biorąc pod uwagę stopień chemicznej stabilności CYN, a także złożony mechanizm jej oddziaływania na żywe organizmy należy przypuszczać, że pod wieloma względami jest to jeden z najbardziej niebezpiecznych związków syntetyzowanych przez sinice. Klasyczne metody oczyszczania wody takie jak destratyfikacja, filtracja czy metody z wykorzystaniem aktywnego węgla stosowane m.in. w oczyszczalniach ścieków oraz stacjach uzdatniania wody w przypadku CYN są mało efektywne (De La Cruz et al., 2013; Moreira et al., 2013). Dlatego tak ważne jest poszukiwanie nowych rozwiązań umożliwiających skuteczne przeciwdziałanie rosnącemu stężeniu tej toksyny w czasie zakwitów sinicowych lub podczas przygotowywania wody konsumpcyjnej czy też oczyszczania ścieków.
Rozkład katalityczny wydaje się obiecującym sposobem dekompozycji CYN. Jest on relatywnie prosty, jednocześnie korzystny ekonomicznie, poza tym, co ważne, możliwy w stosowaniu na szeroką skalę przemysłową. Działanie większości opisanych w niniejszej pracy katalizatorów zapewnia odpowiedni stopień dekompozycji toksyny, a czas potrzebny na zajście tej reakcji jest zadowalający. Warto jednak podkreślić, że stosowane dla układów katalitycznych warunki reakcji, a także wzajemne proporcje stężenia CYN oraz katalizatorów zostały dobrane w taki sposób, aby indukowanie dekompozycji postępowało z dużą szybkością. Wydaje się trudnym osiągnięcie podobnych warunków reakcji np. w naturalnych zbiornikach wodnych, które pokryte zakwitami sinicowymi wykazują wysoce zmienne wartości czynników fizykochemicznych (np. pH czy mętności wody). Dodatkowe utrudnienie stanowią pierwiastki biogenne, metale bądź szeroko pojęte cząstki organiczne, które często występują w wodach naturalnych zbiorników czy ściekach. Dostępne dane wskazują, że ich obecność zdecydowanie zmniejsza efektywność rozpadu toksyny.
Szereg reakcji katalitycznych opisywanych jest w kontekście mechanizmu dekompozycji CYN i formowania się jej pochodnych. W większości przypadków związki te posiadają ciągle relatywnie wysokie masy atomowe i dużą złożoność struktury. Niestety informacje o ich potencjalnej toksyczności są nieliczne, a te, które są dostępne, nie pozwalają z pełną stanowczością stwierdzić, że w warunkach oddziaływania zastosowanych układów katalitycznych, powstają związki neutralne dla żywych organizmów. Doniesienia dotyczące stopnia toksyczności produktów rozpadu CYN wskazują raczej na ich wysoką bioaktywność. Substancje te wykazują toksyczne działanie np. względem komórek ludzkiej skóry czy skorupiaków (Adamski et al., 2019, 2020b). Należy zatem przypuszczać, że pochodne tworzące się w trakcie katalitycznego rozkładu toksyny, jeżeli nie posiadają w porównaniu do wyjściowej formy jej cząsteczki daleko idących modyfikacji strukturalnych (np. pozbawienia grupy sulfonowej czy rozłożenia pierścienia guanidynowego) i niskich mas cząsteczkowych, najprawdopodobniej ciągle wykazują toksyczne właściwości względem żywych komórek.
Celem dalszych badań nad katalizatorami, które przyczyniałyby się do dekompozycji CYN, powinno być zaprojektowanie takiego układu chemicznego, który skutkowałby całkowitym rozkładem toksyny z wytworzeniem produktów o niskich masach cząsteczkowych, bądź całkowitą jej mineralizacją. Katalizator taki powinien być skuteczny w szerokim zakresie czynników abiotycznych. Co najważniejsze, katalizator musi spełniać warunek neutralności względem środowiska naturalnego lub warunek neutralności środowiska reakcji przy zastosowaniu w sektorze przemysłowym.
Niewątpliwie katalityczne usuwanie CYN to potencjalnie najbardziej efektywny sposób zmniejszania nadmiernych wartości jej stężenia w wodach wykorzystywanych przez człowieka. Zaprojektowanie odpowiedniego katalizatora w dużym stopniu przyczyniłoby się do zwiększenia efektywności systemu, który zapobiegałby negatywnym skutkom coraz częściej pojawiających się zakwitów sinicowych.

